DNA修复酶PARPs:从分子机制到临床应用的全景解析
在细胞的复杂世界中,DNA修复酶PARP(PolyADP-RibosePolymerase)扮演着至关重要的角色。这些酶不仅是DNA损伤修复的关键参与者,还在细胞凋亡、基因转录和DNA合成等过程中发挥着重要作用。本文将深入探讨DNA修复酶PARP的功能、作用机制以及其在生物医学领域的应用。
- 最新进展
- 产品信息
- 参考文献
引言
在细胞的复杂世界中,DNA修复酶PARP(PolyADP-RibosePolymerase)扮演着至关重要的角色。这些酶不仅是DNA损伤修复的关键参与者,还在细胞凋亡、基因转录和DNA合成等过程中发挥着重要作用。本文将深入探讨DNA修复酶PARP的功能、作用机制以及其在生物医学领域的应用。
PARP家族简介
PARP家族由17个成员组成,根据结构域结构和功能分为5个亚组:DNA损伤依赖性PARP(PARP1,PARP2和PARP3),tankyrase1/PARP5和tankyrase2/PARP5b,CCCH型PARP(PARP7,PARP12和PARP13),宏观PARP[BAL1/PARP9,BAL2/PARP14和BAL3/PARP15],以及其他PARP (PARP4,PARP6,PARP8,PARP10,PARP11和PARP16)。C末端的催化结构域在所有成员中都是保守的,并且包含额外的锌指、BRCAC末端样(BRCT)基元、锚蛋白重复序列、宏结构域和WWE结构域。
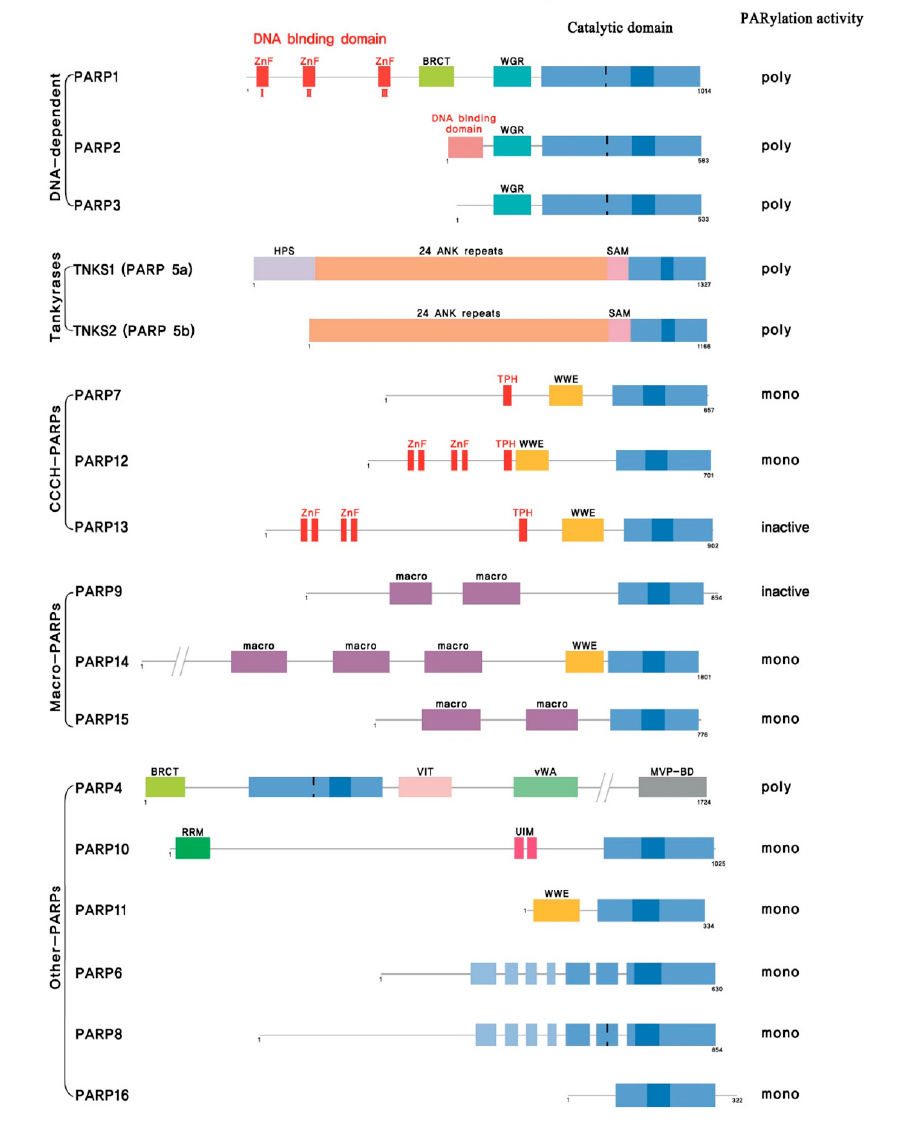
图1:PARPFamily,来源:cancers
PARP1的作用机制
PARylation是ADP-核糖基转移酶利用NAD+将ADP-核糖残基转移到目标底物上的反应。它能快速识别多种类型的DNA损伤,包括SSBs,并被招募到受损部位诱DDR分子的招募,从而使聚(ADP-Ribose)聚合酶(PARP),特别是被称为DDR主要分子的PARP1、PARP2、PARP3、PARP5a和PARP5b在人体中进行聚(ADP-Ribose)(PAR)合成。PARP1是PARP家族中最主要的成员,其在细胞中承担着PARP家族90%以上的功能,是DNA损伤修复中的关键作用因子。
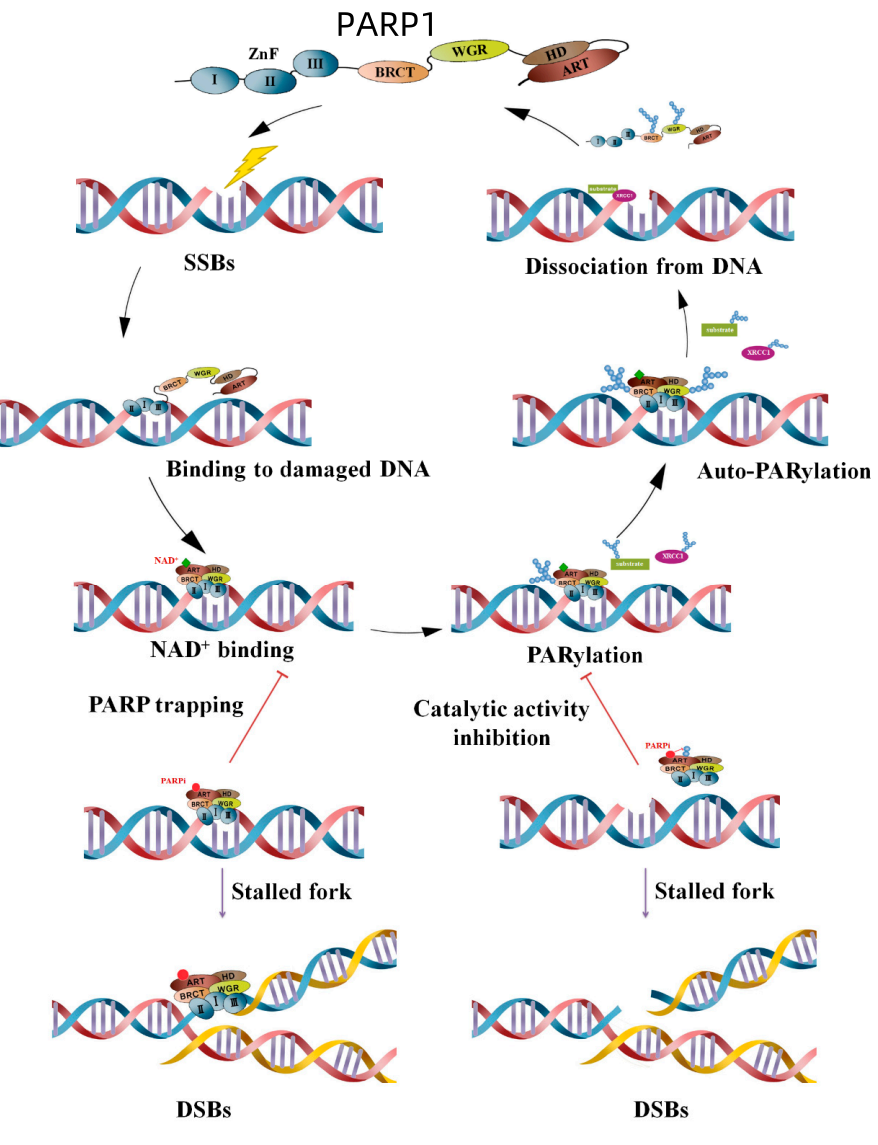
图2:PARylation和PARP抑制在DNA损伤反应中的机制。来源:cancers
当发生DNA单链断裂时,PARP会利用锌指结构域快速结合到损伤位点。通过ART催化结构域以NAD+为底物,催化PARP与其靶蛋白XRCC1、DNA连接酶III等之间的PARylation,从而导致DNA修复蛋白募集到DNA损伤位点。PARP自发PARylation随后会降低对DNA的亲和力,导致其与DNA分离,从而使修复蛋白能够结合。此时,PARP抑制剂会结合口袋而不是NAD+,导致PARP被困在DNA中。它会遇到复制叉,导致其停滞,并转化为双链断裂(DSB),从而导致细胞死亡;或者通过阻断PARP PARylation发生处的酶活性来阻止修复蛋白的募集。
PARPs在生物医学领域的应用
由于PARPs在DNA修复和细胞凋亡中的重要作用,它们已成为生物医学领域的重要研究对象。目前,已有多种针对PARPs的抑制剂被开发出来,用于治疗癌症等疾病。这些抑制剂能够阻止PARPs的活性,从而抑制癌细胞的生长和扩散。同时,这些抑制剂还能够促进癌细胞的凋亡,提高癌症的治疗效果。
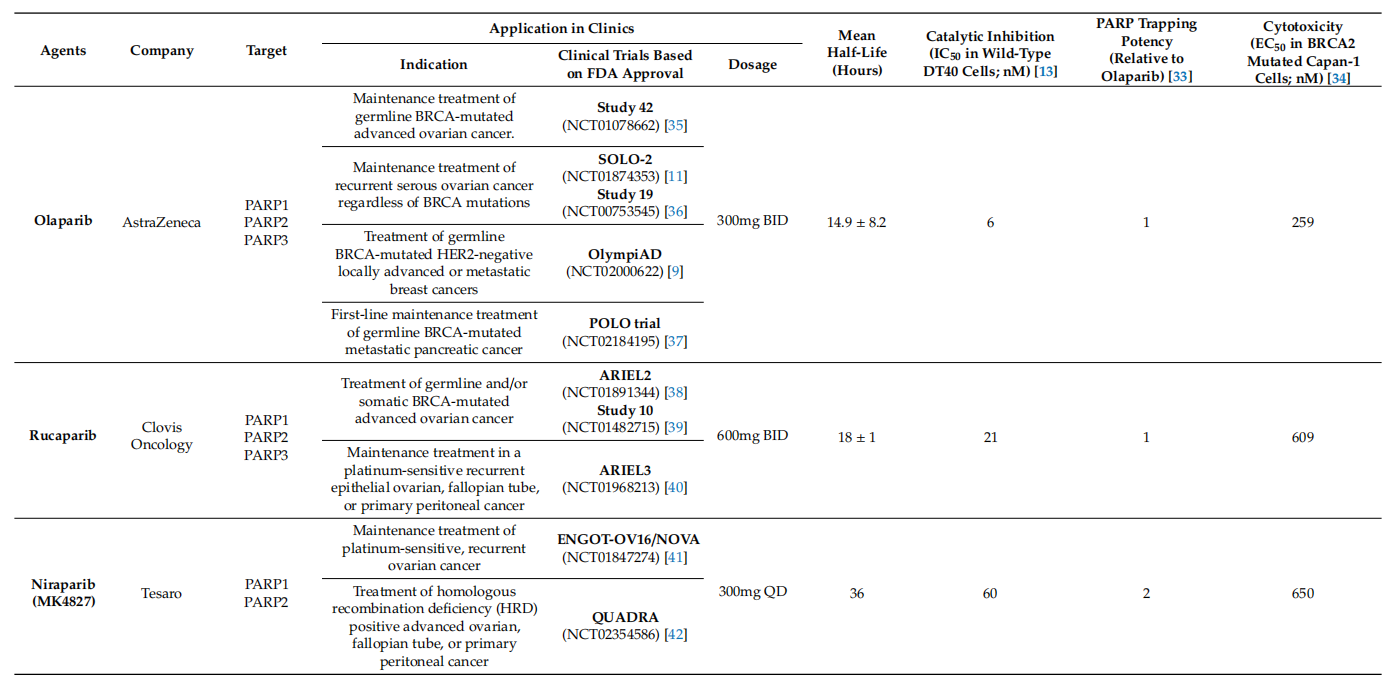
表1.临床上可用的PARP抑制剂的比较。
临床应用PARP抑制剂不仅对BRCA突变的肿瘤,而且对HRD引起的铂敏感肿瘤也有较好的疗效,加速了PARP抑制剂的临床应用。然而,这些PARP抑制剂的作用很难理解为仅仅抑制PARP化的催化活性。虽然四种PARP抑制剂都能抑制PARP1和PARP2的催化作用,但如表1所示,每种PARP抑制剂的细胞毒性不同。PARP抑制剂抑制PARP诱导的细胞毒性远远优于敲除PARP基因诱导的细胞毒性,这表明它们的抗肿瘤作用是由于PARP的催化抑制以外的机制。这种差异可以被概念化为PARP捕获:PARP抑制剂捕获PARP-DNA复合物的能力,同时增加PARP与DNA结合的稳定性。如表1所示,每种PARP抑制剂具有不同的细胞毒性,这与其PARP捕获活性相关。也就是说,talazoparib具有最强的PARP诱捕作用,同时也具有最大的细胞毒性。因此,PARP捕获应被视为PARP抑制剂在临床试验中应用的一种机制。这些PARP捕获能力的差异可能对联合治疗和单一治疗产生不同的影响。
PARP具有多种功能,从转录水平到通过翻译后修饰激活和定位。在DNA损伤应答中,PARP通过PARylation调控自身或其靶蛋白的活化。PARP抑制剂阻断PARP的这种催化活性,阻止正常修复途径的激活。这些PARP抑制剂对BRCA突变等HRD肿瘤具有显著的抗肿瘤作用。迄今为止,已有四种PARP抑制剂获得FDA批准并应用于临床实践。然而,这四种化合物对PARP- DNA复合物的捕获有不同的影响,尽管它们抑制了PARP的共同催化活性。这种PARP捕获通过复制叉崩溃导致细胞毒性改善,导致转化为DSB。当PARP抑制剂与烷基化剂联合使用时,可达到协同作用。相反,抑制PARP的催化活性与拓扑异构酶I抑制剂联合使用时具有协同效应。换句话说,联合治疗与PARP抑制剂的协同作用可以根据个体PARP抑制剂的作用机制而不同地诱导。了解每一种PARP抑制剂的特性,策略性地选择协同伙伴,是产生最大抗肿瘤作用必须考虑的重要问题。
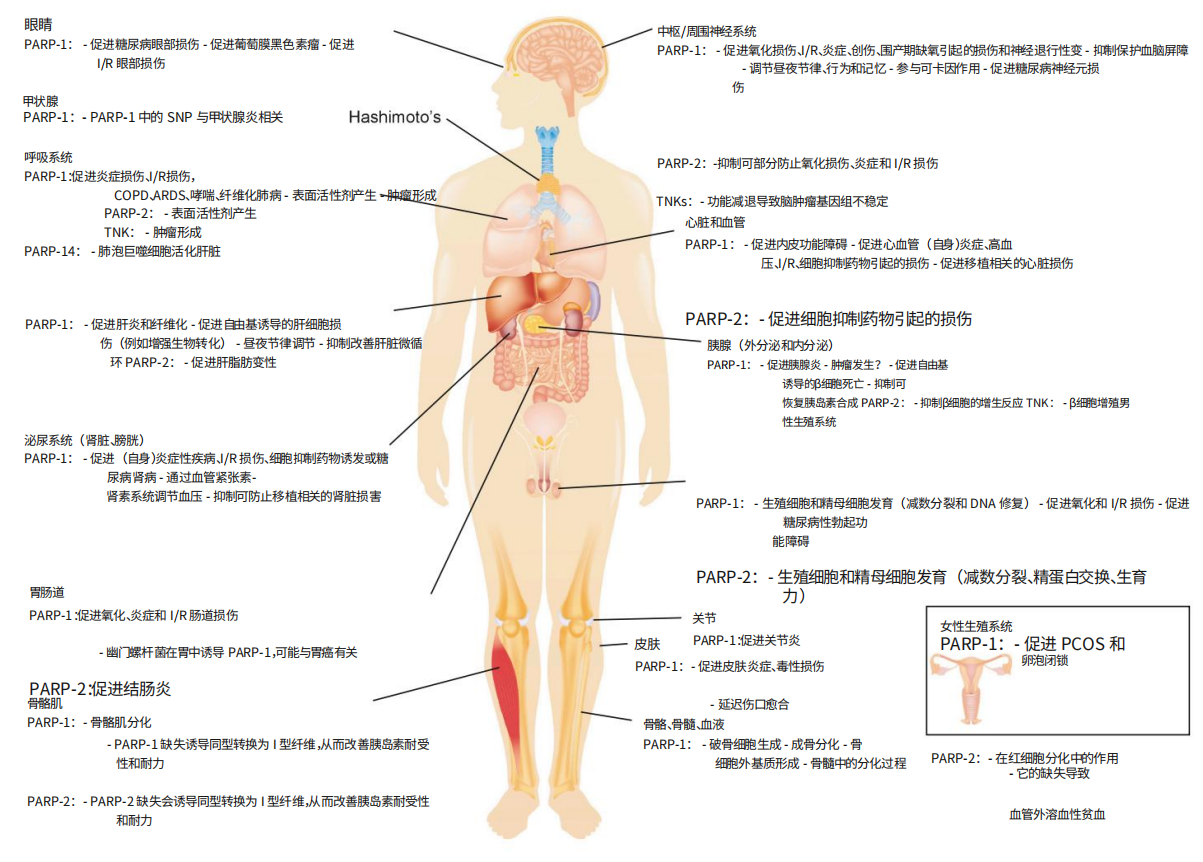
图3. PARP 在人体器官中的作用。来源:CellPress
ARDS,急性呼吸窘迫综合征;COPD,慢性阻塞性肺病;I/R,缺血再灌注;PCOS,多囊卵巢综合征
这些疾病影响所有主要器官系统,包括缺血-再灌注损伤、炎症疾病、烧伤、帕金森病、亨廷顿氏病、阿尔茨海默病和毒性损伤(细胞抑制剂的毒性、香烟烟雾、紫外线和伽马辐射)等。
总结
PARPs在癌症治疗、抗病毒天然免疫、基因编辑、遗传疾病治疗以及其他生物医学领域都具有广泛的应用前景。随着对PARPs功能和作用机制的深入研究,我们有望开发出更多针对PARPs的药物和治疗方法,为人类的健康事业做出更大的贡献。
1. Ahrum Min.et al. PARP Inhibitors as Therapeutics: Beyond Modulation of PARylation.Cancers.2020.
2. O’Neil,N.J.et al.Syntheticle thalityand cancer.Nat.Rev.Genet.2017,18,613–623.
3. Beijersbergen,R.et al.Synthetic Lethalityin Cancer Therapeutics.Annu.Rev.Cancer Boil.2017,1,141–161.
4. Murai, J.et al. Trapping of PARP1 and PARP2 by Clinical PARP Inhibitors. Cancer Res. 2012, 72, 5588–5599.
5. Murai, J.et al. Stereospecific PARP trapping by BMN 673 and comparison with olaparib and rucaparib.Mol. Cancer Ther. 2014, 13, 433–443.
6. Shen, Y. et al. Trapping Poly(ADP-Ribose) Polymerase. J. Pharmacol. Exp. Ther.2015, 353, 446–457.
7. Kaufman, B. et al. Olaparib Monotherapy in Patients With Advanced Cancer and a Germline BRCA1/2 Mutation. J. Clin. Oncol. 2015, 33, 244–250.
8. Peter Bai. et al.Biology of Poly(ADP-Ribose) Polymerases:The Factotums of Cell Maintenance.CellPress.2015.













